《BioSocieties》杂志日前发表的一篇研究指出,关注研发新药质量的重要性,超过了简单关注获批新药的数量。
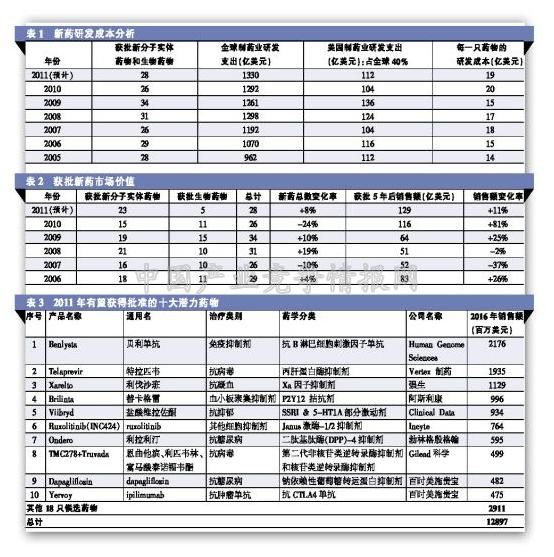
目前,想要详细计算一只新药从研发至上市的成本是一件比较棘手的事情。人们经常引用的每只新药研发成本是由美国制药工业协会(PhRMA)所提供的13亿美元。然而日前在《BioSocieties》杂志上发表的一篇研究显示,目前一只新药研发成本仅为7500万美元,这一数字引起了非常大的争议。更多人相信,新药研发成本在不断上升,这是受到利用FDA批准药物的比率和新药研发支出的理论支撑(见表1)。
新药研发成本难估算
该理论以FDA批准的创新药作为产出指标,各大制药公司宣布的研发支出为投入指标。
鉴于美国市场占全球制药市场的40%,因此研究做了一个假设,美国制药业研发投入也占据了全球制药业研发投入的相同比例。
接下来只要将这些数字平均分解至每年获得FDA批准的新药,这些新药中包含了CBER(生物药物评价和研究中心)及CDER(药物评价和研究中心)批准的新药,这样就能得出每一只新药上市的大致成本。
很明显,这种分析会产生一系列新问题。例如,并不是所有研发投入都直接用于创新药的发现和研究,而且各大制药公司美国研发支出占全球研发支出40%的假设并不可靠,此外还缺乏通货膨胀的调整。
数据显示,过去10年中,新药研发支出翻了一番,全球最大的制药企业开发的创新药还远远不够满足市场需求。
研发效率量质并举
衡量制药业研发的效率是一项复杂的任务。美国FDA批准的新药仅仅是一个简单的晴雨表。新药研发的效率不仅需要从数量,更需要从质量上进行评估。
当然,对新药研发投入所产生的回报进行测量同样是一件非常困难的事。从投资者呼吁大型制药巨头重组,显示了他们对目前所获得的回报并不是很满意。
这些只是短期的修正行为。无论怎样衡量研发效率,制药业仍然需要解释,成功开发一只新药的成本依然在控制范围之内。
如上述对每年获得FDA批准的药物被广泛用于评价新药研发的效率,从这一方面看,2010年获批准的新药数量显著下降,然而从质量角度来看,这些获批新药在临床应用上又是另一番景象。
虽然2010年有26只新药获得FDA批准,创造了10年来的新低,但是这些药物的潜在价值与2009年相比显著提升。2010年获批药物5年后的销售额累计将达到116亿美元。这种研发质量显著得到改善的情况今年将继续,随着28只创新药将于2011年获得FDA批准,这些获批新药5年后的销售额将达到129亿美元(见表2)。
生物制药功不可没
2010年共有5只具有“重磅炸弹”潜力的药物获批,这些药物中包括由CBER批准的创新性生物药,如全球首个前列腺癌疫苗Provenge(sipuleucel-T)和辉瑞新一代肺炎球菌疫苗Prevnar 13(十三价肺炎球菌结合疫苗)。
在对研发效率进行的评价中,必须强调由CBER批准的生物新药的重要性,过去5年中获得批准的新药共增加366亿美元的销售额,其中生物新药增加20%,达75亿美元。除了Prevnar 13和Provenge之外,最近获得批准的生物新药还包括诺华开发的第一种令婴儿产生良好免疫应答的四价流脑疫苗Menveo、Lev公司的遗传性血管水肿预防用药Cinryze(首个获准上市的人C1抑制剂)、默沙东全球第一个获准上市的子宫颈癌疫苗Gardasil、葛兰素史克的宫颈癌疫苗Cervarix、默沙东的新型带状疱疹疫苗Zostavax及轮状病毒疫苗Rotateq、葛兰素史克的轮状病毒疫苗Rotarix。
生物创新药再一次显示了生物新药在市场销售价值增加方面的重要性,生物新药的质量改善在2009年得到体现。
值得一提的是,这些数据是基于目前分析师对市场规模、处方频率和价格的测算,这一切将来都有可能发生变化。例如,今年对2009年获批新药的质量等级有所降低,目前对2009年批准的药物5年之后产生销售预测是64亿美元,比一年前预测的75亿美元下降15%,主要由于受到Multaq(决奈达隆)、Onglyza(沙格列汀、saxagliptin)和Effient(普拉格雷)的销售拖累。
质量获得回报
表3显示了28只2011年有望获得FDA批准的药物中的前十强。其中Benlysta作为创新生物药再次占据榜首,但是其他药物仍然是以小分子药物为主。
另外还有4只潜在"重磅炸弹"药物有望今年获得批准,telaprevir、Xarelto(利伐沙班)和Brilinta(替卡格雷)将分别对Vertex制药、强生和拜耳、阿斯利康的市场前景产生重要的影响。
有趣的是,另外两只今年获得批准的创新药物--Clinical Data公司的Viibryd(维拉佐酮)和武田公司的Edarbi(阿齐沙坦酯)尽管被人们认为是“me-too”产品,但依然按照人们的预期获得批准。对于新药获批大丰收的预测应该谨慎看待。据研究公司伯恩斯坦研究公司(Bernstein Research)最近的一项分析显示,2010年获批准新药的数量创了5年来的新低,2010年所提交的新药申请中仅有50%获得了绿灯,而2005年这一数字为61%。另外,来自FDA顾问委员会积极的推荐意见也降到了3年来的最低点,为60%。他们所认为的新药包括了新分子实体药物、创新性的联合用药、显著不同的适应症以及重新提交申请的药物。
因此,目前希望所有的新药都会按期上市是不可能实现的,但是如果以最有价值的产品作为新药研发的重要标准,2011年新药研发质量将创造一个新高。
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 1
- 2
- 3
- 4